
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Акыркы өзгөртүү 2025-01-22 17:04.
А моль катышы ичиндеги суммаларды байланыштырган конверсия фактору болуп саналат меңдер химиялык реакциядагы каалаган эки заттын. Конверсия коэффициентиндеги сандар тең салмактуу химиялык теңдеменин коэффициенттеринен келип чыгат. Кийинки алты моль катыштары жогоруда аммиакты пайда кылуучу реакция үчүн жазылышы мүмкүн.
Анын моль катышын кантип табасыз?
- Маселеде берилген ар бир элементтин граммынын санынан баштаңыз.
- Мезгилдик таблицадагы молярдык массаны колдонуп, ар бир элементтин массасын мольге айлантыңыз.
- Ар бир моль маанисин эсептелген эң аз моль санына бөлүңүз.
- Эң жакын бүтүн санга тегеректөө. Бул элементтердин моль катышы жана болуп саналат.
Мындан тышкары, эмне үчүн моль катышы маанилүү? Моль катыштары болуп саналат маанилүү анткени моль катыштары өзгөртүүгө мүмкүндүк берет меңдер бир заттын меңдер башка заттан. The моль катышы Адан Бга өзгөргөн сыйкыр болуп саналат моль катыштары химиялык формуладан же теңдемеден келип чыгат.
моль катышы деген эмне?
the катышы суммалардын ортосунда меңдер химиялык реакцияга катышкан ар кандай эки кошулма. Моль катыштары Көптөгөн химиялык маселелерде продуктулар менен реактивдердин ортосундагы конверсия факторлору катары колдонулат.
Mole конверсия деген эмне?
Айландыруу тартып меңдер Көлөмгө (литрге): Көбөйтүңүз мең молярдык көлөм константасы боюнча мааниси, 22,4L. Айландыруу бөлүкчөлөрдөн (атомдордон, молекулалардан же формула бирдиктеринен) чейин меңдер : Бөлүкчөлөрүңүздүн маанисин Авогадро санына бөлүңүз, 6,02×1023.
Сунушталууда:
Сиз шыптын көңдөйүнүн катышын кантип эсептейсиз?

Кадамдар: Бөлмө боштугунун катышы = 2,9; шыптын көңдөйүнүн катышы = 0,0 (чоң чырактар); пол боштук катышы = 1,2 (б.а. 20 x 30 x 3 'тереңдик үчүн) Натыйжалуу шып чагылдыруу =. 80; натыйжалуу пол чагылдыруу =
Үзгүлтүксүз вариация моль катышын кантип аныктайт?

Бул эксперимент эки реагенттин моль катышын аныктоо үчүн үзгүлтүксүз вариация ыкмасын колдонот. Үзгүлтүксүз вариациялар методунда реагенттердин мольдарынын жалпы саны бир катар өлчөөлөр үчүн туруктуу сакталат. Ар бир өлчөө реагенттердин башка моль катышы же моль үлүшү менен жүргүзүлөт
Кыйшык T аралашма катышын кантип табасыз?

Аралаштыруу катышын каныккан аралашуу катышына же буу басымын каныккан буу басымына бөлүү жолу менен табылган. шүүдүрүм чекити жана температура аркылуу өткөн каныккан аралашма катышынын маанисин табыңыз. Андан кийин, шүүдүрүмдүүлүктүн аралашма катышын температуранын аралашма катышына бөлүңүз
Сиз эңкейиш катышын кантип эсептейсиз?
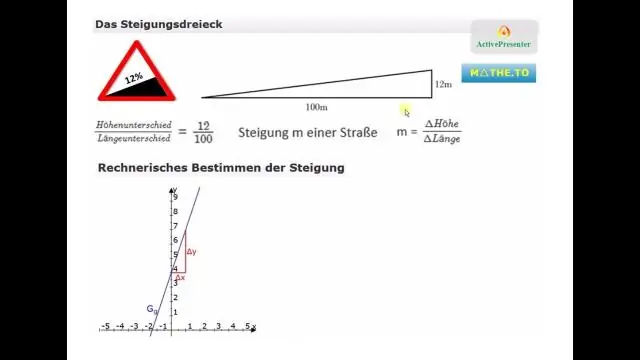
Проценттик эңкейишти эсептөө үчүн, эки чекиттин бийиктиктеринин ортосундагы айырманы алардын ортосундагы аралыкка бөлүңүз, андан кийин бөлүктү 100гө көбөйтүңүз. Чекиттердин ортосундагы бийиктиктин айырмасы көтөрүлүү деп аталат. Токойлордун ортосундагы аралык чуркоо деп аталат. Ошентип, пайыздык эңкейиш (өсүү / чуркоо) х 100гө барабар
Химиялык теңдемедеги моль катышын кантип табасыз?

Моль 1 моль = 6,022*1023 бөлүкчөлөр сыяктуу химиялык эсептөө бирдиги. Стойхиометрия да тең салмактуу теңдемелерди колдонууну талап кылат. Балансталган теңдемеден моль катышын ала алабыз. Моль катышы – балансталган теңдемедеги бир заттын мольдеринин башка заттын мольдерине болгон катышы
