
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Акыркы өзгөртүү 2025-01-22 17:03.
Ошентип, биз эсептөө аны салмактуу алуу менен масса изотоптордун ар биринин жана аларды бирге кошуу. Ошентип, биринчи үчүн масса , биз 84түн 0,50% көбөйтөбүз (amu - атомдук масса бирдик) = 0,042 аму, жана аны 86 аму = 8,51 амунун 9,9% кошуу ж.б.у.с.
Андан кийин, сиз орточо атомдук массаны кантип эсептейсиз?
Орточо атомдук массаны эсептөө The орточо атомдук масса элементтин суммасы болуп саналат массалар анын изотопторунун ар бири табигый көптүгүнө көбөйтүлгөн (пайыз менен байланышкан ондук сан атомдор берилген изотоптун элементи). Орточо атомдук масса = f1М1 + f2М2 +…
Ошондой эле билиңиз, орточо атомдук массаны эсептөө үчүн кандай үч маалымат керек? Элемент үчүн бар изотоптордун саны. The Атомдук Элемент үчүн номер. Ар бир изотоптун пайыздык молдугу.
Ошондой эле, стронцийдин атомдук массасына эң жакын маани кайсы?
Стронций . Комиссия 1961-жылдагы докладында Ар(Sr) = 87,62 негизинде масса -Ньерди спектрометрдик аныктоо. Бул баалуулук А деп кайра каралып чыкканр(Sr) = 87,62 (1) 1969 жана ал бери өзгөрүүсүз бойдон калууда.
Эмненин массасы 1 аму?
Атомдук масса бирдиги (белгиленген AMU же amu) көмүртек-12 атомунун 1/12 массасы катары аныкталат. Көмүртек-12 (С-12) атомунда алты бар протондор жана алты нейтрондор анын ядросунда. Так эмес сөз менен айтканда, бир AMU орточо болуп саналат протон эс массасы жана нейтрон эс массасы.
Сунушталууда:
Атомдун орточо атомдук массасы канча?

Элементтин орточо атомдук массасы - бул анын изотопторунун массаларынын суммасы, алардын ар бири анын табигый көптүгүнө көбөйтүлгөн (берилген изотопко кирген ошол элементтин атомдорунун пайыздары менен байланышкан ондук). Орточо атомдук масса = f1M1 + f2M2 +
Мезгилдик таблицада көрсөтүлгөн орточо атомдук масса кантип аныкталат?

Элементтин орточо атомдук массасы элементтин изотопторунун массаларын кошуу жолу менен эсептелет, алардын ар бири анын Жердеги табигый көптүгүнө көбөйтүлөт. Элементтерди же кошулмаларды камтыган ар кандай массалык эсептөөлөрдү жасап жатканда, мезгилдик таблицада табылган орточо атомдук массаны колдонуңуз
Бордун атомдук массасын кантип эсептейсиз?
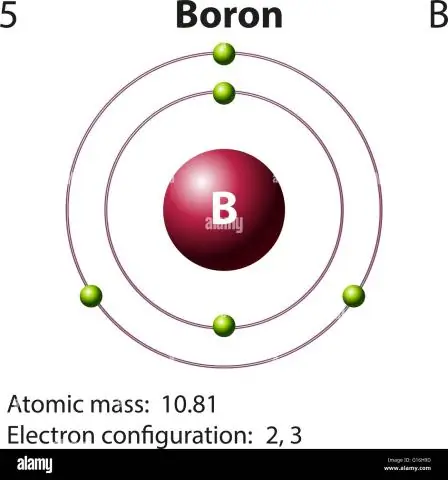
Бор үчүн бул теңдеме мындай болот: 5 протон + 5 нейтрон = 10 атомдук масса бирдиги (AMU) же көбүнчө кездешкен бор изотопу үчүн (болжол менен 5 протон + 6 нейтрон = 11 AMU)
Атомдук массалардын практикалык маселелерин кантип эсептейсиз?

ВИДЕО Анда атомдук массалардын көйгөйлөрүн кантип чечесиз? үчүн эсептөө the атомдук масса элементтин бир атомунун, кошуу масса протондордун жана нейтрондордун. Мисал: табыңыз атомдук масса 7 нейтрон бар көмүртек изотопунун. Көмүртектин бар экенин мезгилдик таблицадан көрө аласыз атомдук саны 6, бул анын протондорунун саны.
Эмне үчүн мезгилдик таблица атомдук масса менен эмес, атомдук саны боюнча түзүлгөн?

Эмне үчүн Мезгилдик таблица атомдук масса менен эмес, атомдук саны боюнча жайгаштырылган? Атомдук номер – ар бир элементтин атомдорунун ядросундагы протондордун саны. Бул сан ар бир элемент үчүн уникалдуу. Атомдук масса протондор менен нейтрондордун бириккен саны менен аныкталат
