
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Акыркы өзгөртүү 2025-01-22 17:04.
In алмаз валенттик электрондор толук коваленттүү байланышта. Бирок ичинде графит үчөө гана коваленттүү байланышта, ал эми бир электрон эркин кыймылдап турат алмаздын эрүү чекити болушу керек караганда жогору ошонун графит анткени ичинде алмаз ичинде төрт коваленттик байланышты үзүшүбүз керек графит үч гана байланыш.
Анын үстүнө, эмне үчүн графиттин эрүү температурасы алмаздан төмөн?
In графит , ар бир көмүртек атому башка үч көмүртек атому менен коваленттик байланыштар аркылуу байланышкан. In алмаз ар бир көмүртек атому коваленттик байланыштар аркылуу башка төрт көмүртек атому менен байланышкан. Демек, бул парадоксалдуу көрүнөт алмаз а болмок төмөнкү эрүү чекити . Бирок, катмарлар графит делокализацияланган электрондорду камтыйт.
Ошондой эле суроо берилиши мүмкүн, эмне үчүн алмаздын эрүү температурасы жогору? Ар бир көмүртек атому башка төрт көмүртек атому менен коваленттик байланышта. Атомдорду бөлүү үчүн көп энергия керектелет алмаз . Себеби коваленттик байланыштар күчтүү, жана алмаз абдан көп коваленттик байланыштарды камтыйт. Бул кылат алмаздын эрүү чекити жана кайноо чекити абдан бийик.
Анда эмне үчүн графиттин эрүү температурасы жогору?
Бирок, графит дагы эле бар жогорку эрүү жана кайноо чекити анткени катмарлардагы көмүртек атомдорун бириктирип турган күчтүү коваленттик байланыштар үзүлүшү үчүн көп жылуулук энергиясын талап кылат.
Эмне үчүн алмаздын эрүү температурасы натрий хлоридинен жогору?
Облигациялар натрий хлориди күчтүү иондук байланыштар болуп саналат, ошондуктан ал бир кыйла жогору эрүү чекити 801C. Бул абдан күчтүү байланыштар жана башкалар алмаз (жана графит) оңой эмес эриген . Чынында, бул заттар жок эритүү бирок улуу (газ түрүндөгү көмүртек атомдоруна айланат).
Сунушталууда:
Эмне үчүн таза заттын эрүү температурасы жогору болот?

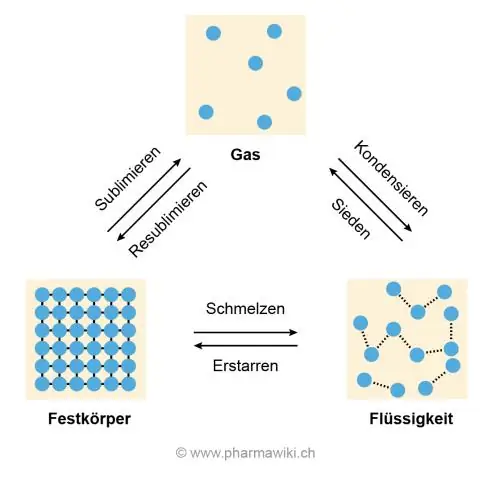
Молекулалар аралык күчтөрдүн ролу Бул күчтөр зат эригенде үзгүлтүккө учурашы керек, бул энергиянын киришин талап кылат. Энергияны киргизүү температуранын жогорулашына алып келет. Демек, катуу нерсени кармап турган күчтөр канчалык күчтүү болсо, анын эрүү температурасы ошончолук жогору болот
Эмне үчүн суунун эрүү температурасы жогору?
Эрүү жана кайноо температураларынын жогору болушунун себеби, суу молекулаларынын ортосундагы суутек байланышы, бул алардын бири-бирине жабышып, ажырашына туруштук берет, бул муз эрип, суу кайнаганда газга айланат
Эрүү температурасы жогору болгон затка кандай байланыш түрү мүнөздүү?

Иондук торчо Бардык иондук бирикмелердин эрүү жана кайноо температурасы жогору, анткени көптөгөн күчтүү иондук байланыштарды үзүү керек. Алар эриткенде же эритмеде өткөрүшөт, анткени иондор эркин кыймылдайт. Аларды электролиз менен ажыратууга болот. Алар көбүнчө сууда эрийт
Эмне үчүн алюминийдин эрүү температурасы натрийге караганда жогору?

Мезгил бою валенттүүлүк жогорулайт (натрийдеги 1 валенттүүлүктөн алюминийдеги 3 валенттүүлүккө чейин), ошондуктан металл атомдору көбүрөөк электрондорду делокализациялап, оң заряддуу катиондорду жана делокализацияланган электрондордун чоңураак деңизин түзүшү мүмкүн. Ошондуктан металлдык байланыш күчөйт жана эрүү температурасы натрийден алюминийге чейин жогорулайт
Эмне үчүн суунун кайноо жана эрүү температурасы жогору?
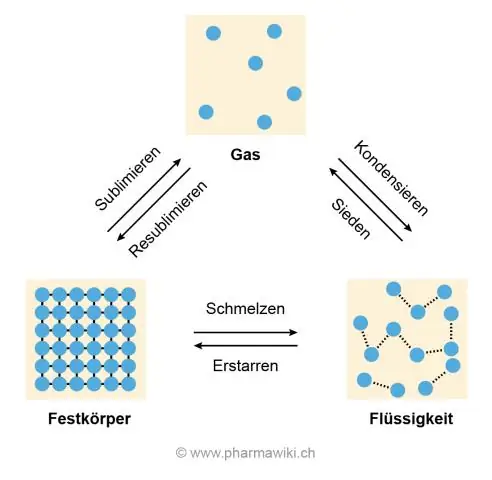
Эрүү жана кайноо температураларынын жогору болушунун себеби, суу молекулаларынын ортосундагы суутек байланышы, бул алардын бири-бирине жабышып, ажырашына туруштук берет, бул муз эрип, суу кайнаганда газга айланат
