
Мазмуну:
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Акыркы өзгөртүү 2025-01-22 17:04.
буфер
- Эгер алсыз болсо кислота . концентрациясын аныктоо кислота (диссоциация жок деп эсептесек). Караңыз же Ка.
- Эгер алсыз болсо кислота ЖАНА коньюгат база . Чечүү буфер үчүн.
- Эгер сизде конъюгат гана болсо база . Чечүү рН үчүн база колдонуу менен Кб жана гидролиз теңдемеси.
Демек, кислота-базалык титрлөө кантип кыласыз?
Титрлөө процедурасы
- Бюретканы стандарттуу эритме менен, пипетканы белгисиз эритме менен, конус колбаны дистилденген суу менен чайкаңыз.
- Эрленмейер колбасына пипетка аркылуу анализденүүчү заттын так өлчөнгөн көлөмүн бир нече тамчы индикатор менен кошо салыңыз.
Ошо сыяктуу эле, титрлөө кантип эсептейсиз? колдонуу титрлөө формуласы . Эгерде титрант менен анализденүүчү зат 1:1 моль катышына ээ болсо, анда формула болуп саналат молярдуулук (М) кислотасынын х көлөмү (V) кислотасынын = молярдуулук (М) базанын х базанын көлөмү (V). ( Молярдуулук болуп саналат концентрация эритменин бир литрине эриген заттын моль саны катары көрсөтүлөт.)
Мындан тышкары, iS F күчтүү же алсыз базабы?
Ошондуктан, И- эң туруктуу жана эң аз негизги, ал эми Ф - эң аз туруктуу жана эң негизги. Мыкты негиздер менен толугу менен өз ара аракеттенет күчтүү HCl сыяктуу кислоталар нейтралдаштыруу реакциясында туз менен сууну пайда кылат. Башка күчтүү негиздер Na сыяктуу эрүүчү оксиддер2О жана эрүүчү гидроксид туздары. Мыкты негиздер болуп саналат күчтүү электролиттер.
Титрлөө эмне үчүн колдонулат?
А титрлөө белгилүү концентрациядагы эритме болгон ыкма болгон белгисиз эритменин концентрациясын аныктоо. Эреже катары, титрант (белгилүү эритме) бюреттен анализденүүчү заттын белгилүү көлөмүнө (белгисиз эритме) реакция аяктаганга чейин кошулат.
Сунушталууда:
Жылдыздардын пайда болуу этаптары кандай?
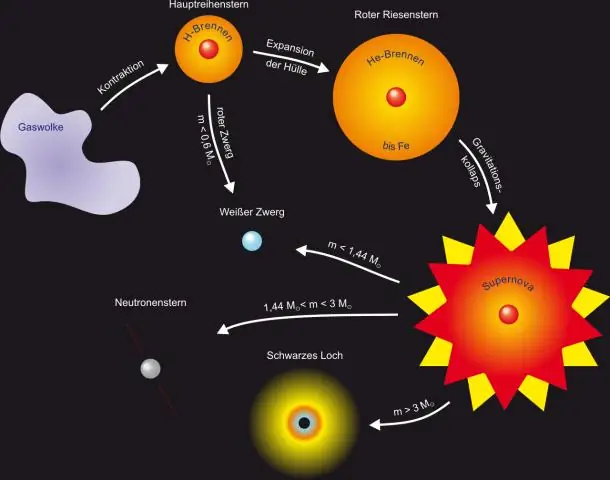
Жылдыздын 7 негизги этаптары Гигант газ булуту. Жылдыз жашоону чоң газ булутунан баштайт. Protostar - бул кичинекей жылдыз. T-Tauri фазасы. Негизги ырааттуу жылдыздар. Кызыл гигантка кеңейүү. Оор элементтердин синтези. Суперновалар жана планеталык тумандуулуктар
Эрозиянын этаптары кандай?

Суу жана шамал эрозиясына мүнөздүү үч кадам: Топурак бөлүкчөлөрүнүн АЖЫРАТЫЛЫШЫ: Бул аракет жамгырдын же шамалдын таасири энергиясы менен топурактан бөлүкчөлөрдү чыгарып салат. Бөлүкчөлөрдү ТАШУУ: Бул аракет топурак бөлүкчөлөрүн кыймылдаган шамалда же сууда ташыйт. Бөлүкчөлөрдү жаңы жерге ЧӨГӨТҮҮ:
Микроскоптун астындагы сүрөттүн чоңойтуусу менен чечүүнүн ортосунда кандай айырма бар?

Чоңойтуу – бул микроскопиялык организмди көрүнөө кылуу сыяктуу кичинекей нерселерди чоңураак кылып көрсөтүү жөндөмү. Резолюция - бул эки объектти бири-биринен айырмалоо жөндөмү. Жарык микроскопиясынын резолюциясынын да, чоңойтуусунун да чеги бар
Теңдемелер системасын алгебралык жол менен чечүүнүн кандай эки жолу бар?

Эки өзгөрмөлүү эки теңдеме берилгенде, аларды чечүүнүн эки алгебралык ыкмасы бар. Бири алмаштыруу, экинчиси жоюу
Теңдемени чечүүнүн этаптары кандай?

Эки кадамдуу алгебралык теңдемени чечүү үчүн сиз өзгөртүүнү кошуу, кемитүү, көбөйтүү же бөлүү аркылуу бөлүп алуу керек. Эки кадамдуу теңдемени бөлүүнүн ордуна аягында көбөйтүү жолу менен чечиңиз. x/5 + 7 = -3 = (x/5 + 7) - 7 = -3 - 7 = x/5 = -10. x/5 * 5 = -10 * 5. x = -50
